抑制劑ML385的作用機制及在氧化應激和腫瘤研究中的應用
核因子E2相關因子 2(Nrf2)是細胞內(nèi)重要的轉(zhuǎn)錄因子,在調(diào)節(jié)氧化應激、炎癥反應及細胞代謝等多種生理過程中發(fā)揮關鍵作用。ML385(AbMole,M8692)作為一種特異性的Nrf2抑制劑,在科研領域受到廣泛關注。它能夠與 Nrf2 蛋白特定結(jié)構(gòu)域結(jié)合,阻斷 Nrf2 的激活及相關信號通路的傳導,進而影響細胞的多種生物學功能。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產(chǎn)物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
一、ML385的作用機制
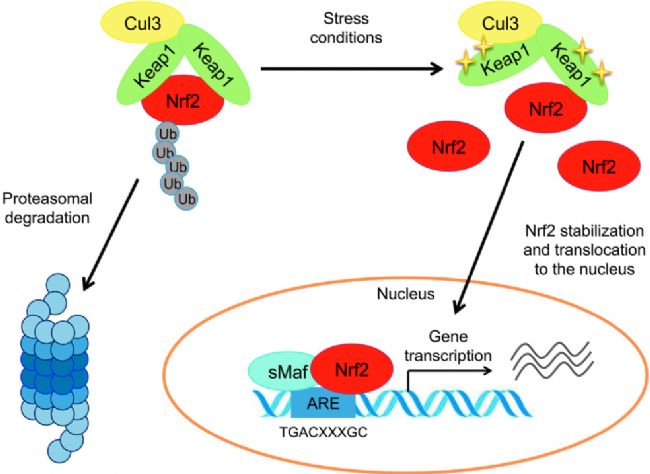
Nrf2是細胞應對氧化應激的關鍵蛋白,在正常生理狀態(tài)下,細胞內(nèi)的氧化還原平衡維持在一定水平,Nrf2與 Kelch樣ECH相關蛋白 1(Keap1)結(jié)合,以無活性形式存在于細胞質(zhì)中。當細胞受到氧化應激刺激時,Keap1上的某些半胱氨酸殘基發(fā)生修飾,導致其與Nrf2的親和力降低,Nrf2得以解離并進入細胞核,與ARE結(jié)合啟動基因轉(zhuǎn)錄。ML385(AbMole,M8692)發(fā)揮抑制作用的首要機制是與Nrf2蛋白直接結(jié)合。研究發(fā)現(xiàn),ML385能夠特異性地與 Nrf2蛋白的 Neh2 結(jié)構(gòu)域相互作用。Neh2結(jié)構(gòu)域是Nrf2與Keap1結(jié)合的關鍵區(qū)域,同時也參與Nrf2的核轉(zhuǎn)位及與 DNA 的結(jié)合過程。ML385與Neh2結(jié)構(gòu)域結(jié)合后,可通過空間位阻效應以及改變Neh2結(jié)構(gòu)域的構(gòu)象,影響Nrf2與 Keap1的解離以及 Nrf2 與 ARE 的結(jié)合能力,從而阻斷Nrf2信號通路的激活。

圖 1. Nrf2激活和調(diào)節(jié)轉(zhuǎn)錄的經(jīng)典途徑[1]
二、ML385的研究應用
1.ML385用于細胞氧化應激研究
在多種細胞模型中,ML385(AbMole,M8692)被廣泛用于研究氧化應激條件下 Nrf2 信號通路的作用[2]。例如,在人AML細胞系MV4-11、 MOLM13中,ML385通過抑制Nrf2信號通路,降低了抗氧化基因(如HO-1、NQO1)的表達,導致細胞內(nèi)ROS水平持續(xù)升高,脂質(zhì)過氧化增加,從而加劇細胞的氧化損傷[2]。還有研究發(fā)現(xiàn),ML385通過抑制Nrf2/HO-1信號通路,可顯著降低細胞的抗氧化能力,增加脂質(zhì)過氧化物MDA含量,降低GSH水平[3]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內(nèi)實驗,相關科研成果發(fā)表于頂刊 Nature 和 Nature Medicine。
2.ML385用于動物模型氧化應激研究
在動物模型研究中,ML385(AbMole,M8692)同樣展現(xiàn)出對氧化應激相關過程的影響。在小鼠脊髓損傷(SCI)模型中,ML385被用作Nrf2抑制劑,以研究Nrf2信號通路在神經(jīng)保護中的作用。結(jié)果表明,ML385顯著削弱了抗氧化劑,如Acacetin(AbMole,M4584),對氧化應激和炎癥的緩解作用,表明Nrf2信號通路在SCI后的抗氧化防御中具有重要作用[4]。在小鼠腸道氧化應激模型中,ML385被用于研究Nrf2信號通路在緩解氧化應激中的作用。結(jié)果顯示,ML385顯著削弱了鞣花酸(AbMole,M2252)對氧化應激的緩解,降低了Nrf2、HO-1和NQO1的表達,增加了MDA水平[5]。
3.抗腫瘤研究
ML385(AbMole,M8692)在多種腫瘤模型中展現(xiàn)出顯著的抗腫瘤活性。在NSCLC模型中,ML385對KEAP1突變導致Nrf2功能增強的細胞具有特異性和選擇性[6]。此外,ML385還通過抑制PI3K-mTOR信號通路,抑制肺鱗狀細胞癌的生長[7]。這些研究表明,ML385可能是一種有前途的腫瘤抑制策略。此外,ML385在研究腫瘤細胞耐藥機制方面也發(fā)揮了作用,研究表明,ML385可以通過阻斷Nrf2/HO-1通路來抑制缺氧誘導的乳腺癌細胞(MDA-MB-231)對抑制劑的耐受[8],ML385還能增強氧化應激損傷和鐵死亡,逆轉(zhuǎn)腫瘤細胞的耐受性[9]。
三、范例詳解
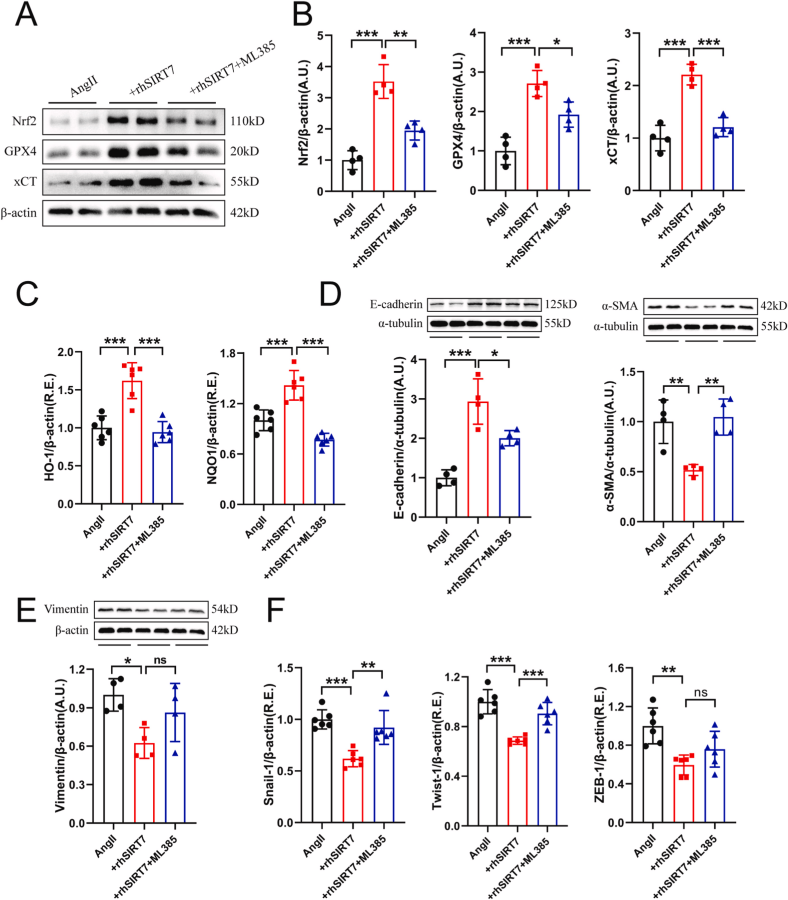
首都醫(yī)科大學朝陽醫(yī)院研究了Sirtuin 7(SIRT7)在高血壓小鼠腎臟損傷中的作用及其機制,特別是其在鐵死亡(ferroptosis)、腎纖維化和氧化應激中的調(diào)控作用。研究結(jié)果表明,SIRT7通過調(diào)節(jié)KLF15/Nrf2信號通路,減輕高血壓引起的腎臟損傷和功能障礙。在這項研究中,AbMole的ML385(AbMole,M8692)被用來驗證Nrf2是否是SIRT7的關鍵下游靶點[10]。最終證實Sirtuin 7通過促進 KLF15/Nrf2 信號傳導減輕高血壓小鼠的腎鐵死亡、纖維化和損傷。

圖 2. Inhibition of Nrf2 by ML385 antagonized rhSIRT7 mediated protective roles of ferroptosis and partial EMT in Ang Ⅱ-stimulated mouse renal TECs[10]

參考文獻及鳴謝
[1] C. Tonelli, I. I. C. Chio, D. A. Tuveson, Transcriptional Regulation by Nrf2, Antioxidants & redox signaling 29(17) (2018) 1727-1745.
[2] Xibao Yu, Yan Wang, Jiaxiong Tan, et al., Inhibition of NRF2 enhances the acute myeloid leukemia cell death induced by venetoclax via the ferroptosis pathway, Cell Death Discovery 10(1) (2024) 35.
[3] Y. Liu, Y. Jia, C. Li, et al., [Dexmedetomidine attenuates heat stress-induced oncosis in human skeletal muscle cells by activating the Nrf2/Ho-1 pathway], Nan Fang Yi Ke Da Xue Xue Bao 45(3) (2025) 603-613.
[4] X. Zhang, L. Xu, X. Chen, et al., Acacetin alleviates neuroinflammation and oxidative stress injury via the Nrf2/HO-1 pathway in a mouse model of spinal cord injury, Transl Neurosci 13(1) (2022) 483-494.
[5] X. Zhang, S. Wang, Y. Wu, et al., Ellagic Acid Alleviates Diquat-Induced Jejunum Oxidative Stress in C57BL/6 Mice through Activating Nrf2 Mediated Signaling Pathway, Nutrients 14(5) (2022).
[6] A. Singh, S. Venkannagari, K. H. Oh, et al., Small Molecule Inhibitor of NRF2 Selectively Intervenes Therapeutic Resistance in KEAP1-Deficient NSCLC Tumors, ACS chemical biology 11(11) (2016) 3214-3225.
[7] L. Ji, N. Moghal, X. Zou, et al., The NRF2 antagonist ML385 inhibits PI3K-mTOR signaling and growth of lung squamous cell carcinoma cells, Cancer Med 12(5) (2023) 5688-5702.
[8] Huan Yang, Wentian Zheng, Hehua Lin, et al., ML385 Suppresses Hypoxia-Induced Drug Resistance and Cancer Stemness of Breast Cancer Cells by Blocking the Nrf2/HO-1 Pathway, Pharmaceutical Chemistry Journal 58(10) (2025) 1506-1513.
[9] L. Yan, H. Hu, L. Feng, et al., ML385 promotes ferroptosis and radiotherapy sensitivity by inhibiting the NRF2-SLC7A11 pathway in esophageal squamous cell carcinoma, Med Oncol 41(12) (2024) 309.
[10] X. T. Li, J. W. Song, Z. Z. Zhang, et al., Sirtuin 7 mitigates renal ferroptosis, fibrosis and injury in hypertensive mice by facilitating the KLF15/Nrf2 signaling, Free radical biology & medicine 193(Pt 1) (2022) 459-473.
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com